Project
4. 転写因子FOXO/DAF-16の多重修飾制御
FoxO (Forkhead box O)ファミリーは、フォークヘッド型とよばれる特徴的なDNA結合ドメインを有する転写因子ファミリーであり、ヒトではFOXO1, FOXO3, FOXO4, FOXO6の4つが知られています。またFoxOは多細胞生物において高度に保存されており、ショウジョウバエではdFOXO、線虫ではDAF-16と呼ばれています。
4-1. FOXO1の多彩な翻訳後修飾
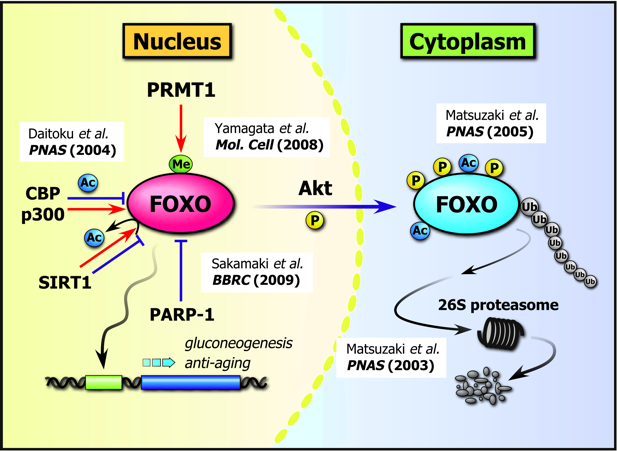
FOXO1の転写調節メカニズムとして、様々な翻訳後修飾の存在が明らかになっています(下図)。その先駆けとなったのは 1999年、Brunetらによるインスリンシグナル依存的なリン酸化によるFOXO1の転写抑制メカニズムの発見でした。
リン酸化
転写因子であるFOXO1は、通常核内に局在して標的遺伝子の転写を活性化しています。ところがインスリンやIGF-Iといったホルモンのシグナルが受容体を介して細胞内に伝達されると、リン酸化酵素であるAkt/PKBが活性化されて核内に移行し、FOXO1の3ヶ所のセリン/スレオニン残基がリン酸化します。その結果、FOXO1は転写の場である核から細胞質へと移行し、転写は抑制されます。
ユビキチン化
ユビキチンはタンパク質の翻訳後修飾分子であり、ポリユビキチン鎖の付加はプロテアソームで分解されるタンパク質の目印になることがわかっています。我々は、FOXO1 がこのユビキチン化修飾とプロテアソームでの分解制御を受けること、またユビキチン化されるためにはFOXO1がAktによってリン酸化され、かつ細胞質に局在していることが必要であることを明らかにしました1。
アセチル化・脱アセチル化
我々は以前から、FOXO1が転写コアクチベーターであるCBP (CREB-binding protein) と結合することを見出していました。CBPは多くの転写因子と結合することでプロモーター上にリクルートされ、転写開始複合体の形成に寄与する一方、ヒストンのリジン残基をアセチル化することで転写を活性化すことが知られています。我々はCBPがFOXO1の転写を活性化する一方で、直接アセチル化してDNA結合能を低下させることを明らかにしました2。この発見に基づき、我々は “FOXO1はCBPを介して転写開始複合体をDNA上にリクルートし、転写を活性化した後、CBPによってアセチル化されてプロモーターから解離し、転写が終結する”という二段階の転写制御モデル“Hit and away model”を提唱しています。
また我々はこの論文で同時に、FOXO1のSIRT1による脱アセチル化についても報告しています。SIRT1はSirtuinファミリーに属するNAD依存的な脱アセチル化酵素であり、線虫においてはオルソログであるsir-2.1の過剰発現で寿命が延長することが報告されていました。後述するように、線虫ではDAF-16も長寿遺伝子としてよく知られていたことから、我々はFOXO1とSIRT1の分子間相互作用を生化学的に解析し、SIRT1が脱アセチル化活性依存的にFOXO1の転写を活性化することを見出しました2。
アセチル化とリン酸化のクロストーク
前述したFOXO1のアセチル化部位がAktによるリン酸化部位と近接していたことから、両者の影響を検討したところ、FOXO1はアセチル化されるとリン酸化修飾されやすくなることを見出しました3。この分子メカニズムとして、FOXO1のアセチル化がDNA結合能を減弱させることでDNAにマスクされていたリン酸化ターゲット部位を露出させ、Aktによるリン酸化を受けやすくするというモデルを考えています。
アルギニン残基のメチル化
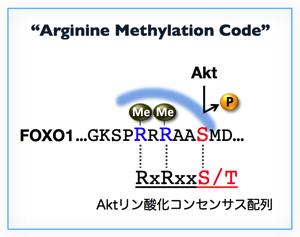
アルギニン残基のメチル化を触媒するPRMT(protein arginine methyltransferase)ファミリーは、哺乳類では11種類からなり、このうちPRMT1は転写制御、DNA修復やシグナル伝達制御など多岐にわたる細胞機能に関与しています。我々は、PRMT1がFOXO1のAktリン酸化コンセンサス配列 (RxRxxS/T, xは任意のアミノ酸)内の2ヶ所のアルギニン残基をメチル化すること、またこのメチル化はAktによるリン酸化を阻害することを明らかにしました4(下図)。すなわちPRMT1は、FOXO1をアルギニンメチル化することでインスリンシグナルと拮抗し、FOXO1の転写活性を維持していると考えられます。さらに興味深いことに、このPRMT1によるAktコンセンサス配列のメチル化は、アポトーシス促進因子であるBAD(Bcl-2 antagonist of cell death)でも認められ、FOXO1と同様にAktによるリン酸化が阻害されました5。以上の知見は、PRMT1によるAkt基質のアルギニンメチル化が、Aktシグナル伝達経路の抑制機構として普遍的に働いている可能性を示唆しており、我々はこれをアルギニンメチル化コードと呼んでいます。
その他の翻訳後修飾
我々はFOXO1において、上述した修飾以外にも、Erkやp38によるリン酸化6やPCAFによるアセチル化7、PARP-1によるポリADPリボシル化8などを発見しています。一方で海外のグループからも、リジンメチル化やモノユビキチン化、糖鎖付加などが報告されており、以上を踏まえると、FOXO1の多重翻訳後修飾による活性調節機構が、他に類を見ないほど複雑かつ巧妙であることが示唆されます9。
- Matsuzaki H., Daitoku H., Hatta M., Tanaka K. and Fukamizu A.
Insulin-induced phosphorylation of FKHR (Foxo1) targets to proteasomal degradation
Proc. Natl. Acad. Sci. USA 100, 11285-11290 (2003) - Daitoku H., Hatta, M., Matsuzaki H., Aratani S., Oshima T., Miyagishi M., Nakajima T. and Fukamizu A.
Silent information regulator 2 potentiates Foxo1-mediated transcription through its deacetylase activity
Proc. Natl. Acad. Sci. USA 101, 10042-10047 (2004) - Matsuzaki H., Daitoku H., Hatta M., Aoyama H., Yoshimochi K. and Fukamizu A.
Acetylation of Foxo1 alters its DNA-binding ability and sensitivity to phosphorylation
Proc. Natl. Acad. Sci. USA 102, 11278-11283 (2005) - Yamagata K.*, Daitoku H.*, Takahashi Y., Namiki K., Hisatake K., Kako K., Mukai H., Kasuya Y. and Fukamizu A.
Arginine methylation of FOXO transcription factors inhibits their phosphorylation by Akt
Mol. Cell 32, 221-231 (2008)
*These authors contributed equally to this work. - Sakamaki JI, Daitoku H., Ueno K., Hagiwara A., Yamagata K. and Fukamizu A.
Arginine methylation of BCL-2 antagonist of cell death (BAD) counteracts its phosphorylation and inactivation by Akt
Proc. Natl. Acad. Sci. USA 15, 6085-6090 (2011) - Asada S., Daitoku H., Matsuzaki H., Saito T., Sudo T., Mukai H., Iwashita S., Kako K., Kishi T., Kasuya Y. and Fukamizu A.
Mitogen-activated protein kinases, Erk and p38, phosphorylate and regulate Foxo1
Cell Signal. 3, 519-527 (2007) - Yoshimochi K., Daitoku H. and Fukamizu A.
PCAF represses transactivation function of FOXO1 in an acetyltransferase-independent manner
J. Recept. Signal. Transduct. 30, 43-49 (2010) - Sakamaki JI., Daitoku H., Yoshimochi K., Miwa M. and Fukamizu A.
Regulation of FOXO1-mediated transcription and cell proliferation by PARP-1
Biochem. Biophys. Res. Commun. 382, 497-502 (2009) - Daitoku H., Sakamaki JI. and Fukamizu A.
Regulation of FoxO transcription factors by acetylation and protein-protein interactions
Biochem. Biophys. Acta. 1813, 1954-1960 (2011)
4-2. DAF-16/FOXO1の標的遺伝子と個体機能
DAF-16はFoxOサブファミリーに属する線虫 (C. elegans) の転写因子であり、哺乳類のFOXO1やFOXO3のオルソログに相当します。この遺伝子が最初に注目されたのは、線虫を用いた寿命調節遺伝子の発見にさかのぼります。
線虫の長寿遺伝子DAF-16
線虫 (C. elegans) は体長1㎜ほどで約1,000個の体細胞からなる最もシンプルな多細胞モデル動物であり、平均寿命が2週間程度と短い上に、遺伝学解析が容易であることから老化研究によく用いられてきました(図)。1993年、Kenyonらによる線虫の突然変異体の解析の結果、daf-2とよばれる遺伝子の機能が低下した変異体は野生型に比べて寿命が3倍近く延長することが明らかになりました。daf-2遺伝子がコードするタンパク質は哺乳類のインスリン/IGF-I受容体と高い相同性をもち、下流のPI3K-Aktシグナル経路も線虫に高く保存されています。さらに重要なことは、daf-2変異体にdaf-16変異体を掛け合わせた二重変異体で、長寿命が完全にキャンセルされてdaf-16変異体と同程度の寿命(野生型よりやや短命)になることです。DAF-16がDAF-2シグナルの下流で負に制御されていることを考えると、daf-2変異体の長寿命は、非リン酸化状態のDAF-16による標的遺伝子の転写活性化に起因すると考えられます。さらに近年、食餌制限や生殖細胞系列の欠損などのdaf-2変異体とは独立した寿命延長経路においても、その長寿命にdaf-16遺伝子が必須であることが報告されていることから、DAF-16/FOXOの活性調節機構の解明は、寿命制御の本質的理解につながるものと考えられます。
我々は哺乳類FOXO1遺伝子の研究で蓄積した知見を、線虫DAF-16の個体機能である寿命制御にフィードバックすることで、寿命・老化メカニズムの解明に挑んでいます。

- Tamiya H., Hirota K., Takahashi Y., Daitoku H., Kaneko Y., Sakuta G., Iizuka K., Watanabe S., Ishii N. and Fukamizu A.
Conserved SAMS function in regulating egg-laying in C. elegans
J. Recept. Signal. Transduct. 33, 56-62 (2013) - Takahashi Y., Daitoku H., Hirota K., Tamiya H., Yokoyama A., Kako K., Nagashima Y.,
Nakamura A., Shimada T., Watanabe S., Yamagata K., Yasuda K., Ishii N. and Fukamizu A.
Asymmetric arginine dimethylation determines life span in C. elegans by regulating forkhead transcription factor DAF-16
Cell Metab. 13, 505-516 (2011) - Takahashi Y., Daitoku H., Yokoyama A., Nakayama K., Kim JD. and Fukamizu A.
The C. elegans PRMT-3 possesses a type III protein arginine methyltransferase activity
J. Recept. Signal. Transduct. 31, 168-172 (2011)
哺乳類におけるFOXO1の飢餓応答
グルコース(ブドウ糖)は生体にとって最も利用しやすいエネルギー源であり、全身の細胞は必要なグルコースを血液中から取り込んでいますが、空腹状態が続いて炭水化物の摂取が不足すると、生体は脂肪細胞に貯蔵している脂肪酸を血中に放出して、グルコースに代わるエネルギー源とします。しかし脳や赤血球は脂肪酸を代謝できないため、エネルギー源を血中からのグルコース供給に頼らざるを得ません。したがって血中グルコース濃度(血糖値)は常に基底レベルを維持する必要がありますが、その要求に応えているのが肝臓による血中へのグルコースの供給です。肝臓は空腹時(低血糖時)のグルコース供給に備え、食後の高血糖時に分泌されるインスリンに応答して血中グルコースからグリコーゲン(グルコースの重合体)を合成し、一時的に貯蔵します。そしていざ空腹状態が長く続き肝臓のグリコーゲンが枯渇すると、生体は血糖値を維持するため、肝臓において、乳酸、アミノ酸、グリセロールなどからグルコースを生成し、これを血中に供給する独自の代謝機構(糖新生)を発動させます。FOXO1は糖新生の律速酵素であるG6PaseやPEPCKの発現を誘導することで、空腹時における血糖値維持に重要な役割を果たしています。またII型糖尿病の発症原因のひとつに糖新生の亢進が関与していると考えられており、FOXO1を介した糖新生の制御メカニズムの研究が、糖尿病の発症メカニズムの解明へとつながることが期待されます。
- Sakamaki JI, Daitoku H., Kaneko Y., Hagiwara A., Ueno K. and Fukamizu A.
GSK3β regulates gluconeogenic gene expression through HNF4α and FOXO1
J. Recept. Signal. Transduct. 32, 96-101 (2012) - Ito Y., Daitoku H. and Fukamizu A.
Foxo1 increases pro-inflammatory gene expression by inducing C/EBP beta in TNF-alpha-treated adipocytes
Biochem. Biophys. Res. Commun. 378, 290-295 (2008) - Aoyama H., Daitoku H. and Fukamizu A.
Nutrient control of phosphorylation and translocation of Foxo1 in C57BL/6 and db/db mice
Int. J. Mol. Med. 18, 433-439 (2006) - Yamagata K., Daitoku H., Shimamoto Y., Matsuzaki H., Hirota K., Ishida J. and Fukamizu A.
Bile acids regulate gluconeogenic gene expression via small heterodimer partner-mediated repression of hepatocyte nuclear factor 4 and Foxo1
J. Biol. Chem. 279, 23158-23165 (2004) - Hirota K., Daitoku H., Matsuzaki H., Araya N., Yamagata K., Asada S., Sugaya T. and Fukamizu A.
Hepatocyte nuclear factor-4 is a novel downstream target of insulin via FKHR as a signal-regulated transcriptional inhibitor
J. Biol. Chem. 278, 13056-13060 (2003) - Daitoku H., Yamagata K., Matsuzaki H., Hatta M. and Fukamizu, A.
Regulation of PGC-1 promoter activity by protein kinase B and forkhead transcription factor FKHR
Diabetes 52, 642-649 (2003)

