Project
3. 血圧恒常性の維持と破綻
血圧は常に一定の範囲にて制御されており、生体の恒常性にとって、正常血圧の維持は重要です。生活習慣病の代表として挙げられる高血圧症の患者は、現在、約2700万人とされています。しかしながら、その原因は未だ明らかとなっていません。当研究室では、この血圧制御を担う複数のホルモン-受容体系に関して、マウス個体を用いた発生工学や分子生物学を駆使し、正常血圧、また、高血圧疾患の制御メカニズムの解明を目指しています。現在は、以下の3つのテーマを中心に研究を行っています。
3-1 レニン・アンジオテンシン系と血圧恒常性
3-2 妊娠時疾患とレニン・アンジオテンシン系
3-3 アペリン-APJ系による循環器制御
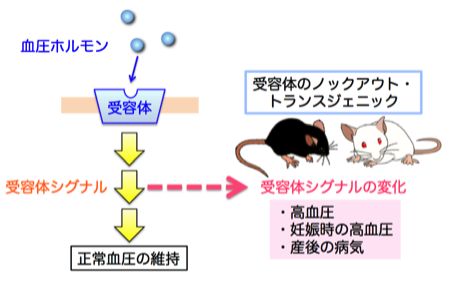
3-1. レニン・アンジオテンシン系の血圧恒常性

レニン・アンジオテンシン系(Renin-Angiotensin System:RA系)は、生体の血圧調節、および、電解質バランスの維持に重要な酵素-ホルモン系です。RA系の唯一の基質であるアンジオテンシノーゲンは主に肝臓で産生され、血中へと分泌されます。主に腎臓で産生される酵素レニンは、このアンジオテンシノーゲンを切断し、アンジオテンシンI(AI)が生成され、AIはさらにアンジオテンシン変換酵素(ACE)により、アンジオテンシンII(AII)へと変換されます。AIIは、RA系の最終生理活性ペプチドであり、特異的受容体(AT1)を介して血管収縮や、腎臓における水・電解質の再吸収を促進するなど、血圧を上昇の方向へと導いています。私たちは、マウス個体にて遺伝的にRA系を活性化、または、欠損させることにより、RA系の血圧制御における意義を解明してきました。
1)血圧制御におけるRA系の重要性(ノックアウトマウスによる検証)
RA系の唯一の基質であるアンジオテンシノーゲン、RA系の律速酵素であるレニン、また、アンジオテンシンIIの血圧上昇作用を担うAT1a受容体について、それぞれの遺伝子ノックアウトマウスを作製しました。これらマウスは、著しい低血圧を示したことから、RA系は、個体内において他の系では代償することが出来ない、正常血圧の維持に必須な血圧制御系であることが証明されました。また、それぞれのマウスにて、腎臓の形成異常や水腎症が観察され、腎臓の形成や機能維持にもRA系は極めて重要であることが明らかとなりました(J. Biol. Chem. 1994、J. Biol. Chem. 1995、J. Biol. Chem. 2000)。
2)RA系の病態生理学的役割(トランスジェニックマウスを用いた検討)
RA系の消失、もしくは、シグナル抑制にて正常血圧保てないことが判明しましたが、RA系の亢進の影響については不明でした。そこで、ヒト・レニン遺伝子導入マウスと、ヒト・アンジオテンシノーゲン遺伝子導入マウスを作製し、それらの交配により、ヒトの両遺伝子をもつ子マウスを作製しました。この、ヒト・アンジオテンシノーゲンとヒト・レニンの両遺伝子を同一個体にて併せ持つ子マウスでは、ヒトのRA系が再構築され、過剰なAIIが産生、そして、慢性的な高血圧を呈しました(つくば高血圧マウス)。このことは、RA系の亢進は高血圧の原因となることを示しています(J. Biol. Chem. 1993)。
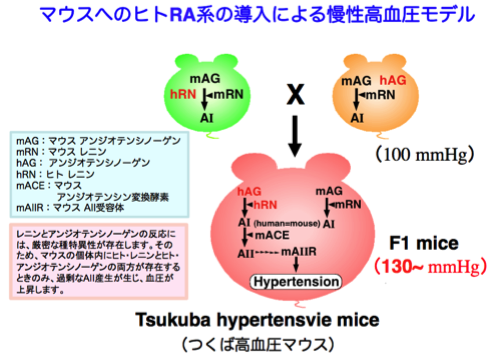
つくば高血圧マウスでは、過剰なアンジオテンシン産生によって、著しい高血圧に加えて、心肥大や臓器障害を含む様々な高血圧病態が観察されることが判明しています(J. Biol. Chem. 1993、Lab. Invest. 1997、Lab. Invest. 1998)。現在、RA系の機能亢進と疾患との関連研究に関しては、次項で述べる妊娠時疾患との関わりに関して研究を進めています。
[references]
- Fukamizu, A., Sugimura, K., Takimoto, E., Sugiyama, F., Seo, MS., Takahashi, S., Hatae, T., Kajiwara, N., Yagami, K., and Murakami, K.
Chimeric renin-angiotensin system demonstrates sustained increase in blood pressure of transgenic mice carrying both human renin and human angiotensinogen genes.
J. Biol. Chem. 268, 11617-11621 (1993) - Tanimoto, K., Sugiyama, F., Goto, Y., Ishida, J., Takimoto, E., Yagami, K., Fukamizu, A., and Murakami, K.
Angiotensinogen-deficient mice with hypotension
J. Biol. Chem. 269, 31334-31337 (1994) - Sugaya, T., Nishimatsu, S., Tanimoto, K., Takimoto, E., Yamagishi, T., Imamura, K., Goto, S., Imaizumi, K., Hisada, Y., Otsuka, A., Uchida, H., Sugiura, M., Fukuta, K., Fukamizu, A., and Murakami, K.
Angiotensin II type 1a receptor-deficient mice with hypotension and hyperreninemia
J. Biol. Chem. 270, 18719-18722 (1995) - Sugiyama, F., Haraoka, S., Watanabe, T., Shiota, N., Taniguchi, K., Ueno, Y., Tanimoto, K.., Murakami, K., Fukamizu, A., and Yagami, K.
Acceleration of atherosclerotic lesions in transgenic mice with hypertension by the activated renin-angiotensin system
Lab. Invest. 76, 835-842 (1997) - Nishijo, N., Sugiyama, F., Kimoto, K., Taniguchi, K., Murakami, K., Suzuki, S., Fukamizu, A., and Yagami, K.
Salt-sensitive aortic aneurysm and rupture in hypertensive transgenic mice that overproduce angiotensin II
Lab. Invest. 78, 1059-1066 (1998) - Ishida, J., Sugiyama, F., Tanimoto, K., Taniguchi, K., Syouji, M., Takimoto, E., Horiguchi, H., Murakami, K., Yagami, K., Fukamizu, A.
Rescue of Angiotensinogen-Knockout Mice
Biochem. Biophys. Res. Commun. 252, 610-616 (1998) - Kakinuma, Y., Hama, H., Sugiyama, F., Yagami, K., Goto, K., Murakami, K., and Fukamizu, A.
Impaired blood-brain barrier function in angiotensinogen-deficient mice
Nature Med. 4, 1078-1080 (1998) - Taniguchi, K., Sugiyama, F., Kakinuma, Y., Uehara, S., Nishijho, N., Tanimoto, K., Murakami, K., Fukamizu, A., and Yagami, K.
Pathologic characterization of hypotensive C57BL/6J-agt: angiotensinogen-deficient C57BL/6J mice
Int. J. Mol. Med. 1, 583-587 (1998) - Yanai, K., Saito, T., Kakinuma, Y., Kon, Y., Hirota, K., Taniguchi-Yanai, K.,
Nishijo,N.,Shigematsu, Y., Horiguchi, H., Kasuya, Y., Sugiyama, F., Yagami, K., Murakami, K.,and Fukamizu, A.
Renin-dependent Cardiovascular Functions and Renin-independent Blood Brain Barrier Functions Revealed by Renin-deficient Mice
J. Biol. Chem. 275, 5-8 (2000)
3-2. 妊娠時疾患とレニン・アンジオテンシン系
1)RA系の機能亢進と妊娠高血圧症候群(妊娠高血圧マウスの開発)
妊娠に伴って母体では様々な生理変化が生じ、様々な妊娠イベントに対して母体が適応することで、妊娠恒常性が維持されています。一方で、これら妊娠環境の変化への不適応は、妊娠時疾患の発症へと繋がります。妊娠高血圧症候群は、代表的な妊娠時疾患で、発症率は全妊婦の約5%と高頻度です。妊娠後期の高血圧や腎障害を主病態とし、各臓器傷害や子宮内胎児発育遅延などを呈し、重篤な場合は母子の生命にとって大きなリスクとなっています。しかしながら、対象が母体と胎児であることがから、研究は困難であり、現在まで発症原因は特定されておらず、有効な治療法も確立されていません。
深水研究室では、ヒト・アンジオテンシノーゲン遺伝子導入マウスの雌に、ヒト・レニン遺伝子導入マウスの雄を交配することで、妊娠したメスマウスが妊娠後期に顕著な高血圧を引き起こすことを明らかとしました(妊娠高血圧マウス)。この妊娠高血圧マウスは、妊娠後期の高血圧に加えて、顕著な尿タンパクや心臓、胎盤の組織傷害、また、胎児の子宮内発育遅延など、ヒトの妊娠高血圧症候群と類似した症状を示します(Science 1996、Mol. Endocrinol. 2005、Lab. Invest. 2008)。

これまでの解析から、AII受容体であるAT1aが病態の発症や進展に重要であること、をAT1a遺伝子ノックアウトマウスや、AT1受容体阻害剤を用いた解析から明らかにしています(FASEB J. 2004、Hypertens. Res. 2008、Vasc. Healt. Risk Manag. 2009、J. Biochem. 2011、Mol. Med. Reports 2013)。最近ヒトにおいてもAT1シグナルの亢進が妊娠高血圧症候群のリスクを大きく高める可能性が報告されつつあり、深水研究室では現在、妊娠高血圧マウスを用いて、AT1シグナル下流にて存在する、病態の形成と進展の責任因子の解析を行っています。
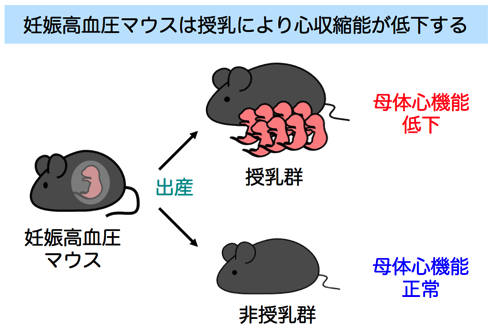
2)妊娠高血圧症候群が産後の母体に与える影響
妊娠高血圧症候群は、妊娠中の高血圧や蛋白尿を主徴とする疾患ですが、近年、産後の母体の心血管疾患発症リスクを増加させることが報告されています。また、授乳は母体の閉経後の心疾患発症リスクを低下させる一方で、妊娠中から産後に起こる心不全(周産期心筋症)の発症に関連することが示唆されています。しかしながら、妊娠高血圧症候群と授乳の両者が産後の心臓に与える影響は不明でした。そこで当研究室では、前述の妊娠高血圧モデル(PAH)マウスを用いて、産後のPAH マウス心臓に対する授乳の影響を検討しました。その結果、授乳を行ったPAH マウスにおいて心収縮力の低下が認められました(野生型マウスでは授乳を行っても心機能は正常でした)。この結果により、妊娠高血圧の既往がある場合、授乳は産後母体における心収縮力低下の原因となる可能性が示唆されました(Endocrinology 2013) 。
[references]
- Takimoto, E., Ishida, J., Sugiyama, F., Horiguchi, H., Murakami, K., and Fukamizu, A.
Hypertension indcued in pregnant mice by placental renin and maternal angiotensinogen
Science 274, 995-998 (1996) - Saito, T., Ishida, J., Takimoto-Ohnishi, E., Takamine, S., Shimizu, T., Sugaya, T., Kato, H., Matsuoka, T., Nangaku, M., Kon, Y., Sugiyama, F., Yagami, K., and Fukamizu, A.
An essential role for angiotensin II type 1a receptor in pregnancy-associated hypertension with intrauterine growth retardation
FASEB J. 18, 388-390 (2004) - Takimoto-Ohnishi, E., Saito, T., Ishida, J., Ohnishi, J., Sugiyama, F., Yagami, K., and Fukamizu, A.
Differential roles of renin and angiotensinogen in the feto-maternal interface to the development of complications of pregnancy
Mol. Endocrinol. 19, 1361-1372 (2005) - Furuya, M., Ishida, J., Inaba, S., Kasuya, Y., Kimura, S., Nemori, R., and Fukamizu, A.
Impaired placental neovascularization in mice with pregnancy-associated hypertension
Lab. Invest. 88, 416-429 (2008) - Sakairi, A., Ishida, J., Honjo, K., Inaba, S., Nakamura, S., Sugiyama, F., Yagami, K., Fukamizu, A.
Angiotensin type 1 receptor blockade prevents cardiac remodeling in mice with pregnancy-associated hypertension
Hypertension Res. 31 2165-2175 (2008) - Furuya, M., Ishida, J., Aoki, I., and Fukamizu, A.
Pathophysiology of placentation abnormalities in pregnancy-induced hypertension
Vasc. Health Risk Management 4 , 1301-1313 (2009) Review - Ishida, J., Matsuoka, T., Saito-Fujita, T., Inaba, S., Kunita, S., Sugiyama, F., Yagami, KI., Fukamizu, A.
Pregnancy-associated homeostasis and dysregulation: Lessons from genetically modified animal models
J. Biochem. (2011) Review - Ishimaru T., Ishida J., Nakamura S., Hashimoto M., Matsukura T., Nakamura A., Kunita S., Sugiyama F., Yagami K., Fukamizu A.
Short-term suppression of the renin-angiotensin system in mice associated with hypertension during pregnancy.
Mol. Med. Report 6, 28-32 (2012) - Murata K, Saito C, Ishida J, Hamada J, Sugiyama F, Yagami K, Fukamizu A.
Effect of lactation on postpartum cardiac function of pregnancy-associated hypertensive mice.
Endocrinology 154, 597-602 (2013)
3-3. アペリン-APJ系による循環器制御
近年、心血管系疾患において7回膜貫通型受容体からのシグナルが、その病態の進行や抑制に重要であることが判ってきています。深水研究室では、血圧調節に重要なアンジオテンシン1型受容体(AT1)と高い相同性をもつ、マウス7回膜貫通型受容体・APJに関して、APJが担う生理機能の解明を目指しています。
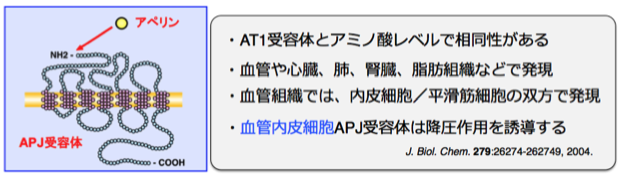

これまでに、APJ受容体遺伝子ノックアウトマウスを世界に先駆けて作製し、APJ受容体と血圧制御との関連を検証したところ、APJ受容体はリガンドであるアペリンに応答して、降圧系として機能すること、またこの血圧降下作用は血管を弛緩させる一酸化窒素系(NO)を介していることを証明しました。さらに、APJ受容体遺伝子欠損マウスは、昇圧ホルモンであるアンジオテンシンIIへの感受性が亢進していることから、APJ受容体が高血圧などの病態時に血圧上昇作用に対して拮抗的に働いている可能性を明らかとしています。(J. Biol. Chem. 2004)。
APJ受容体は、細胞遊走活性を有することや、疾患により血管機能が低下する場合に、むしろ血圧を上昇させる方向に作用することを突き止めており、血圧制御のみならず、様々な循環器疾患や発生分化などに関与する可能性があります。現在は、血管や心臓におけるAPJ受容体機能に焦点を当てて、正常と異常との制御について研究を進めています。
[references]
- Ishida, J., Hashimoto, T., Hashimoto, Y., Nishiwaki, S., Iguchi, T., Harada, S., Sugaya, T., Matsuzaki, H., Yamamoto, R., Shiota, N., Okunishi, H., Kihara, M., Umemura, S., Sugiyama, F., Yagami, KI., Kasuya, Y., Mochizuki, N., and Fukamizu, A.
Regulatory roles for APJ, a seven-transmembrane receptor related to AT1, in blood pressure in vivo
J. Biol. Chem. 279, 26274-26279 (2004) - Hashimoto, Y., Ishida, J., Yamamoto, R., Fujiwara, K., Asada, S., Kasuya, Y., Mochizuki, N., and Fukamizu, A.
G protein-coupled APJ receptor signaling induces focal adhesion formation and cell motility
Int. J. Mol. Med. 16, 787-792 (2005) - Hashimoto, T., Kihara, M., Sato, K., Matsushita, K., Tanimoto, K., Toya, Y., Fukamizu, A., and Umemura, S.
Expression of cyclooxygenase-2 in the juxtaglomerular apparatus of angiotensinogen gene-knockout mice
Nephron Physiol. 102, 1-8 (2005) - Hashimoto, T., Kihara, M., Ishida, J., Imai, N., Yoshida, SI., Toya, Y., Fukamizu, A., Kitamura, H. and Umemura, S.
Apelin stimulates myosin light chain phosphorylation in vascular smooth muscle cells
Arterioscler. Thromb. Vasc. Biol. 26, 1267-1272 (2006) - Hashimoto, T., Kihara, M., Imai, N., Yoshida, SI, Shimoyamada, H., Yasuzaki, H., Ishida, J., Toya, Y., Kiuchi, Y., Tamura, K., Yazawa, T., Kitamura, H., Fukamizu, A., and Umemura, S.
Requirement of apelin-apelin receptor system for oxidative stress-linked atherosclerosis
Am. J. Pathol. 171, 1705-1712 (2007) - Hamada, J., Kimura, J., Ishida, J., Kohda, T., Morishita, S., Ichihara, S., and Fukamizu, A.
Evaluation of novel cyclic analogues of apelin
Int. J. Mol. Med. 22, 547-552 (2008) - Nagano K, Ishida J, Unno M, Matsukura T, Fukamizu A.
Apelin elevates blood pressure in ICR mice with L-NAME-induced endothelial dysfuncsion.
Molecular Medicine Reports (2013)

