Stratagene社 Quick changeTM site directed mutagenesis kitが一般的にはよく用いられる方法らしい。ここではその改良版について概説する。点変異や欠失(150bp位はやったことがある)に有効である。
利点; primerが1本で済むので安価である。
複数箇所に同時に変異を入れることが可能である。
A. Primerの5'末端リン酸化: カスタムメイドしたオリゴヌクレオチドは5'末端がリン酸化されていないので予めリン酸化しておく。
1. Primer作製
センス、アンチセンス、どちら側のプライマーでも構わないので、導入したい配列を含み両側が糊となるようにオリゴヌクレオチドを注文する。2箇所同時に変異を導入したい場合は同じ側にプライマーを注文する。糊の長さは片側10~13bp位がよいと思う。
2. Primerの5'末端リン酸化
Primer 100pmol
10xT4 PNKbuffer 5ul
50mMATP 1ul
T4 PNK(NEB) 1ul(10U/ml)
MilliQ 43ul
37℃ 30min incubation
# この状態で-20℃に保存可能。
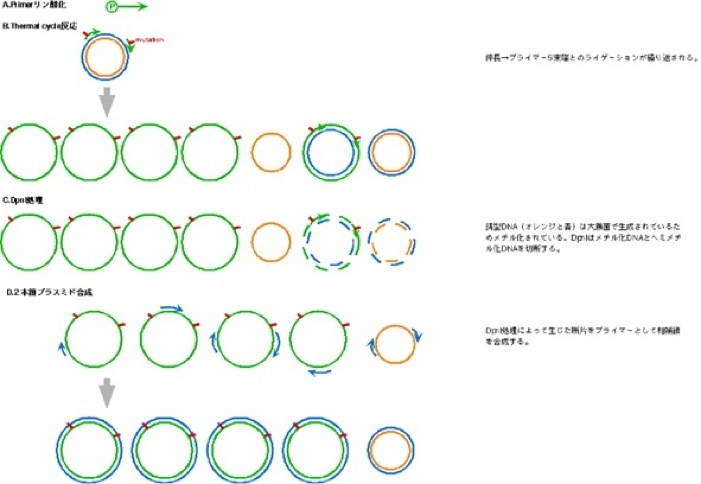
B. Thermal cycle反応
1. reaction mixtureの作製#
Template plasmid 10ng
リン酸化済みPrimer 10~20pmol
10xPfu buffer 2.5ul
10xTaq ligase buffer 2.5ul
dNTPmixture(2.5mMeach)
Pfu DNA polymerase(Stratagene) 1ul (2.5U)
Taq DNA ligase(NEB) 0.5ul (20U)
MilliQでTotal 50ulに調整。
2. PCR
65℃ 5min x1
95℃ 2min x1
95℃ 10sec x20~25
55℃ 30sec
65℃ 7min (2min以上/1kb)
75℃ 7min x1
4℃
C. DpnI処理
上記sample 50ul
DpnI 1ul
37C 1hr.
#Bの反応を行ったPCR tubeでそのまま行うことが可能である。
D. 2本鎖プラスミド合成
上記sample 51ul#
#Bで加えたPfuとTaq ligaseの持ち越しの活性でこのステップを行うことが可能である。このステップの前に4℃で一晩おいた場合にはPfu0.5ulを加えて反応する。Taq ligaseは必要ない。
95℃ 30sec. x1
95℃ 30sec. X2
55℃ 1min.
70℃ 7min (2min以上/1kb)
75℃ 7min x1
4℃
E. Transformation
上記sample 10ul
E.coli. 90ul
いつも通りに行う。L-brothでの回復は最低でも20~60 min.はやっています。
コロニーが10個くらい生えてくればたいてい1コロニーはあたっています。
