1. Restriction enzyme digestion
↓ mix them
Genome DNA 2ug
10×buffer 2ul
Restriction enzyme (H.C.) 0.5ul
H2O 15.5μl
Total 20ul
↓ 37℃、2hr.以上
↓ add 4ul of 6 x dye solnユ
↓ ready to electrophoresis
・Genome DNA量は、アガロースゲルとして
Mupid(50 ml, 17レーンコーム)の場合は、1 well当たり1ug
Large gel(150 ml, 19レーンコーム)の場合は、1 well当たり3~5ug
・Restriction enzymeはHigh Concentrationを用いる。
・反応は20ul系で行い、Mupidの場合は半量を、large gelの場合は全量をアプライする。
酵素反応中の準備
・ 0.7% Agarose gel(Sigma, A-6013)
・・・large gelはEtBr入りで。Mupidは泳動が乱れるので後染め
・ 1 x TAE buffer(泳動用)
・ Alkali buffer(Blotting用、800~1000 ml/blot)
NaOH 16g(0.4N)
NaCl 35g(0.6M)
DW up to 1000 ml
・ Nylon membrane(Gene Screen Plus, NEN Life Science、ゲルと同じ大きさ x 1枚)
・ 濾紙(3MM paper、ゲルと同じ大きさを3枚、17 x 17cm を2枚)
2. Electrophoresis
↓ 0.7% Agarose gel electrophoresis
Mupid・・・running 30min.
Large gel・・・stacking 15min.
running 2hr.
↓ Mupidで泳動した場合はEtBr染色、30min.
↓ ポラロイドで写真撮影
↓ ゲルをAlkali buffer中にて30min. with gently shaking
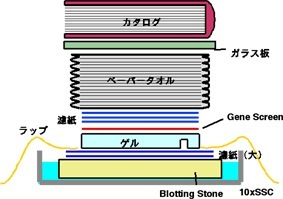
3. Alkali transfer (右図を参照)
↓準備
・ Alkali buffer、Nylon membrane、濾紙(泳動中にカット済み)
・ 金属パッド(大)・・・ブロッティング用
・ 金属パッド(小)・・・メンブレンを浸すため
・ ブロッティングストーン(Blotting Stone 18x18cm, S&S社)
・ ピンセット、ボールペン、サランラップ、紙タオル、500g程度のカタログ(重石用)
↓ Nylon membraneの右上(ウェルの外)にプローブ名を記入
↓ 金属パッド(小)にAlkali bufferを少し入れ、Nylon membraneを浸す(10min.)
↓ ブロッティング(乾燥、気泡に注意して)
↓ 金属パッド(大)にAlkali bufferを約400ml入れる
(Blotting Stoneがちょうど吸いきる量)
↓ Blotting Stoneを気泡が入らないように斜めにして入れる
↓ Blotting Stoneにbuffer かける
↓ 乾かないうちにAlkali bufferで濡らした濾紙(17cm×17cm、2枚)をセット
(気泡が入らないように1枚ずつ手早く)
↓ bufferをかけつつ、ゲルを裏返しにしてセット(気泡に注意)
(2枚同時にtransferをする場合はwell同士を向かい合わせで)
↓ bufferをかけ、ピンセットでウェルの位置に穴をあける
↓ Nylon membraneを表側がゲルに接する方向でセット(気泡注意)
↓ bufferをかけ、濾紙(membraneと同じ大きさ、3枚)をbufferでしめらせた後、1枚ずつmembrane上にセット
↓ Blotting Stoneの厚さの9割ほどAlkali bufferを金属パッド(大)に加える
↓ ゲル以外の部分をサランラップで覆う
↓ ペーパータオルをのせる
↓ PAGE用のガラス板をのせ、200g程度の試薬ビンをセットし重さに馴染ませる(10min)
↓ 重しを500g程度のカタログに変えて4~8hr.
4. Neutralization ~ dry in air
↓ Neutralization Solnユの調整
1 M Tris-HCl (pH=7~8) 50ml
5 M NaCl 20ml
MilliQ・H2O 30ml
Total 100ml
↓ 金属パッド(小)にNeutralization Solnユを入れる
↓ ペーパータオル、ラップをはずす
↓ ピンセットでゲル、Nylon membrane、濾紙 x 3をまとめてつかみ、ずれないようにひっくり返す
↓ ボールペン(油性)にて、wellの位置をNylon membraneに写し取る
↓ ゲルを剥がし、Nylon membraneを乾かない内にNeutralization Solnユに浸す(Blot面を上向きに)
↓ Neutralization 30min. with gently shaking
↓ Nylon membraneを取り出しペーパータオル上にて表面のNeutralization Solnユを完全に吸わせる
↓ 風乾 1hr.(このまま保存可能。その場合はPre-hybridizationを1hr.以上行う)
この後のHybridizationは、probeに放射性ラベルを用いる方法と、化学発光を用いる方法がある。
感度的には放射性ラベルを用いる方法の方が良いが、化学発光でも1copyの導入、欠損を判別することが可能なほど最近では感度が良くなっているので、どちらの方法でも良い。
放射性ラベルは比較的安価だが、取り扱いに注意し専用施設で行う必要がある。
化学発光は実験室にて普通に行うことができるが、放射性ラベルよりも高価である。
ゲノムサザンで初めて用いるプローブに関しては、感度や再現性の面から放射性ラベルを用いる方法で検討を行い、うまくいくと判ったプローブに関しては、化学発光を用いる方法でも行っている。
プラスミドサザンは最初から化学発光の方法で良い。
Chemiluminescent detection with CDP-Star
AlkPhos DIRECT(amersham pharmacia biotech)
Labelling kit:25反応分(RPN 3680)
CDP-Star detection reagent:2500cm2分(RPN 3682)
1. プローブのラベリング
↓ 準備
・ Probe DNA:500~1000 bp程度の特異的領域のDNA断片(100ng/reaction)
(初めての遺伝子の場合は3領域ほどProbeを設定し、コントロールサザンで一番きれいにバンドが出るものを用いるようにする)
・ reaction buffer(kit内)
・ labelling reagent(kit内)
・ pure-H2O(kit内)
・ cross-linker solnユ(原液:kit内)
・ Heat-Block(100℃)、37℃ 恒温槽
↓ cross-linker solnをpure-H2Oにて5倍希釈(ピペッティング)⇒ cross-linker working solnユ
(working solnユ:冷蔵庫にて1週間保存可能。ホルムアミドを含むので調整時は手袋着用)
↓ DNA(or RNA)断片100ngをpure-H2Oにて10ulに調整(10ng/ul:核酸濃度は50 mM以内)
↓ DNA solnをHeat-Blockにてheat denature、5min.
(Heat-blockの穴に氷を入れて沸騰させたところでboil)
↓ on ice immediately、5min.
↓ spin-down
↓ reaction buffer(赤キャップ)を10ul加える
↓ labelling reagent(黄キャップ)を2ul加える
↓ cross-linker working solnユを10ul加え、ピペッティングで混合
↓ spin-down
↓ 37℃ 恒温槽にて30min.
↓ すぐにPre-Hybridizationを行う場合はon iceにて2hr.はOK.
(長期保存はequal vol.の100% glycerolを加え、-20℃にて6ヶ月まで)
2. Pre-hybridization
↓ 準備
・ 原液Hybridization buffer(kit内、室温保存、白ボトル)
:含12%(w/v)urea。Hybridization buffer調整に使用
・ Blocking reagent(kit内、室温保存、白バイアル)
・ NaCl(analytical grade)
↓ Hybridization bufferの調整
(10ml/40~80cm2 blot。10mlに対してProbeは50ng分使用)
↓ mix them
原液Hybridization buffer 50 ml
NaCl (analytical grade) 1.46g(0.5M)
Blocking reagent 2g(4% w/v)
↓ dissolve completely 30min.~2hr.(~O/N)
(三角フラスコにて、時折恒温槽で暖めながら)
↓ 10mlづつ分注 ~ -20℃にて3ヶ月間保存可能
↓ Hybridization buffer(10ml)を55℃にて温める
(温度はProbeによって異なる。非特異が多い場合は60~65℃まで。Hybridization温度と合わせる)
↓ ハイブリバッグにBlot後のNylon membraneを入れてコンパクトにシールする
↓ 55℃に温められたHybridization buffer(9ml)をパックに注ぎ、軽く馴染ませる
(残りの1mlはそのまま55℃にて温め続ける)
↓ 空気を大まかに抜いて上部をシールする
↓ 55℃の恒温槽に沈めてPre-hybridization開始(60回/分にて振とうしても良い)
・ 風乾1hr程度~Pre-hybridizationは15min.以上
・ 風乾1日以上~Pre-hybridizationは1hr.以上
3. Hybridization
↓ 55℃にて温めてある残りのHybridization buffer(1ml)にラベルされたProbe DNAを入れる
↓ よく混ぜた後、また55℃にて温める
↓ Pre-Hybridizationのパックを取り出し、開封。
↓ Bufferの温度が下がらない内に、55℃のラベル ProbeをピペットマンにてNylon membraneに当たるように入れる。Probeの最終濃度は5~10ng/mlとなるように
(Probeを入れる温度をなるたけHybridizationの温度のままで行うのがポイント。
ピペットマンでmembraneに当てて入れるのは、ロスを防ぐため)
↓ Probeが均一になるまで丁寧にBufferを対流させ混ぜる(10回以上)
↓ いったん泡もBufferもパックの底に落として、その後、気泡が残らないようにBufferごと持ち上げ、ちょうど良いところでBufferだけ落としてmembraneの少し上でシールしてパックする
↓ パックされたmembraneをさらにハイブリバックに入れ2重にパックする
↓ Bufferが対流することを確認して、55℃の恒温槽に沈め、60回/分にて振とう
↓ Hybridization 4hr.~O/N(時間があるならO/Nで)
4. Washing
↓ 準備
Primary wash buffer・・・・・40cm2あたり100ml以上(80~200ml)
stock add final conc.
4M Urea solution 200ml(or powder 48g) 2M
10% SDS solution 4ml 0.1%
0.5M Na phosphate (pH7.0) 40ml 50mM
5M NaCl 12ml 150mM
1M MgCl2 0.4ml 1mM
Blocking reagent 0.8g 0.2%
H2O 256.5ml
total 400ml 4℃にて1week保存可
(Na phosphate (pH7.0)のpH調整は、sodium hydroxideにて行う)
Secondary wash buffer(20 x stock)
add final conc.
Tris base 121g 1M
NaCl 112g 2M
adjust pH to 10.0 with HCl
H2O up to 1000ml 4℃にて4ヶ月保存可
Secondary wash buffer(working soln)・・・・・40cm2あたり100ml以上(80~200ml)
stock add
20×Secondary wash buffer 20ml
1M MgCl2 800ul
H2O up to 400ml 保存不可、要時調整
Primary washing
↓ Primary wash bufferを55℃に温める(2回分。100mlで複数のBlotをwash可能)
↓ 100mlのPrimary wsh bufferを深底金属パッドに入れる(55℃)
↓ Hybridizationを終了し、パックからmembraneを取り出しPrimary wash buffer中へ
↓ wash for 10min at 55℃ with gently shaking(1回目)
↓ wash bufferを捨て、再度fresh Primary wash bufferにてwash 10min.(2回目)
Secondary washing
↓ Secondary wash bufferを100mlパッドに入れる(室温)
↓ membraneをSecondary wash bufferのパッドに移し、室温にて5min. with gently shaking(1回目)
↓ 再度、室温にてSecondary wash 5min. (2回目)
(発光前にSecondary wash buffer 中で30min、室温にて保存可)
5. Chemiluminescent detection with CDP-Star
↓ 過剰なwash bufferをペーパーに吸わせる
注意(1)Blot面を上向きで、(2)完全には乾かさないように
↓ CDP-Star solutionのドロップ(30~40ul/cm2 membrane)をサランラップの上に作る
↓ membraneをBlot面がCDP-Star solutionに触れる向きで室温にて2~5min.静置
↓ 感光用の台紙をラップで覆う(membraneをこの上に乗せる)
↓ ラップしてある台紙にmembraneをBlot面が上向きで乗せる
↓ 台紙をさらにラップで覆い、solutionが漏れないようにキムタオルを台紙の裏に添える
(1) 気泡は丁寧に押し出す
(2) membraneは感光時を通して乾燥させない
↓ 室温にてX線フィルムに感光 1hr.(X線フィルムが濡れないように注意する)
(シグナルは数時間後をピークに数日間続くので感光時間を調節する)
(Amersham PharmaciaのTyphoonなどの、発光を検出できるイメージアナライザーで感光・取り込み・解析することもできる。また、X線フィルムをスキャナでコンピュータに取り込めば画像解析ソフトにて定量やFig.作製ができる)