Radioimmuno assay for Renin-angiotensin system(齊藤 知子)
<原理>
あるタンパクの量を測定したい場合に,放射線標識した既知濃度の同じタンパクを用いて,それに対する抗体を競合的あるいは,非競合的に結合させ,未知の標本の濃度を決定する.マウスやヒトの個体を用いた場合,個体間のばらつきが大きい上に,酵素抗体反応が基本の定量実験であるため,条件検討のためのpre実験をしていかなくてはならない.さらに,最終的なデーターをとる時には,一回の実験において全てを行うことで,反応条件を一定にし,データーのばらつきを最小限にする.すなわち,pre実験できっちり条件が決まれば,後は一気に本実験を行えばいいのである.そこで,pre実験の条件検討を中心に記載した.以下のプロトコールは,下図の A)-E)についてのものである.
注)incubate以外は,全てon iceで行うこと.
☆Radioimmuno assay (RIA)の流れ
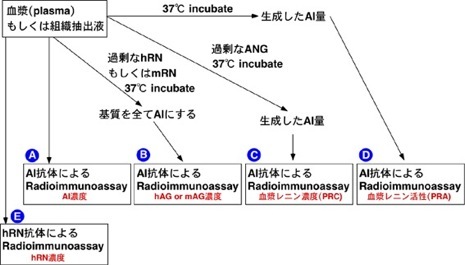
A,AI量
Pre 実験 radioimmunoassayにおける検量線内に入るplasma もしくはtissue extractsの量の条件を決定する.
Plasma もしくはtissue extracts 5-95ulの間でふる.
5mM PMSF
5mM EDTA
AI generation buffer
Total 100ulを2連でRadioimmunoassayにもっていく.
検量線に収まる量を本実験の条件とする.
B,hAGまたはmAG濃度
Pre実験 基質であるhAGとmAGの濃度を求めるため,さらに酵素reninを加えて,全てAIにしてから,その濃度を決定する方法である.
Pre 実験では1)加えるレニン活性の測定と,基質溶液となるsampleに対して,2)過剰量になるrenin量の条件を決定する.
1) レニン活性の測定
レニンsolution 25ul レニンをRIA bufferで希釈したもの.基質溶液の1/10量を加える.
Hog Substrate solution 225μl Hog substrate (75ng),5mM EDTA,5mM PMSF fill up by AI generation buffer
total 250ul×レニンsolution を希釈した本数分(レニンを加えないものも含む)
↓37℃,60min.
↓on ice
↓×1,×10,×100にRIA bufferにて希釈して,それぞれ100ul分を2連でRadioimmunoassayにもっていく.
一番大きな値が出たrotのレニンを,assayに用いる.
注)結果の値は,レニンを加えなかったときの値を引いたもので求められる.単位はng AI/ml renin solution / hr また,加える酵素と基質の種特異性に注意すること.
2) 過剰となるRN量
今までの文献からsampleに含まれるAG量を推定する.1)で決定したrotのレニンを用いて,その推定値から10倍の活性を持つレニン量を加えるようにする.
レニンsolution 25ul
plasma もしくはtissue extract 加える量は以前の経験値による
5mM PMSF
5mM EDTA
AI generation buffer
total 250ul×時間数分
↓37℃,0,20,40,60,90min.ほど,時間をふる.
↓on ice
↓×1,×10,×100にRIA bufferにて希釈して,それぞれ100ul分を2連でRadioimmunoassayに持っていく.

上図で示したような時間と,加えたレニン量が本実験での条件となる.
注)結果の値は,もともとサンプル中に含まれる,AI量を引いた後,(incubate 0min.の値を引く.)
×50にすることで求められる.AG (60000; M.W.)/AI (1296.5; M.W.)=50より 単位はng AG量/ml plasma or mg protein of tissue
C,血漿レニン濃度(PRC)
Pre実験 Plasma中に含まれる最大レニン活性を求めるため,外から過剰量となる基質(AG)を加えなくてはならない.その条件を検討する.外から加える基質量は,経験値 のPRAを参考にして加えてみる.
Plasma solution 25ul plasmaをRIA bufferで希釈したもの.基質溶液の1/10量を加える.
Hog Substrate solution 225μl Hog substrate (量は,経験値を参考に),5mM EDTA,5mM PMSF fill
up by AI generation buffer
total 250ul×(hog substrateの量+時間)分
↓on ice
↓×1,×10,×100にRIA bufferにて希釈して,それぞれ100ul分を2連でRadioimmunoassayにもっていく.

一定量のsubstrateに対する,それぞれの反応時間を60min.あたりのAI量に換算して,一番大きい値が出た時間をその濃度のPRCとして,上図のようにグラフを作った場合,示したポイントを本実験の条件に決定する.また,検量線の範囲に入った希釈濃度も本実験の条件にする.
注)結果の値は,もともとサンプル中に含まれる,AI量を引くことで求められる.(incubate 0min.の値を引く.)単位はng AI/ ml plasma or mg protein of tissue/ hr
D,血漿レニン活性(PRA)(Plasma に含まれるレニン活性 ; plasma中に存在する基質の濃度にも左右される)
Pre実験 一時間あたりの最大AI 生成量であるので(AIを作りうるレニンの能力)
1. 反応速度の高い条件
2. 検量線に収まるplasmaの量の条件 を求める.
AI generation buffer で希釈したplasma
5mM EDTA
5mM PNSF
total 250ul×時間数分
↓37℃,0,40,60,90min.ほど,時間をふる.
↓on ice
↓×1,×10,×100にRIA bufferにて希釈して,それぞれ100ul分を2連でRadioimmunoassayにもっていく.
それぞれの反応時間を,60min.あたりのAI量に換算して,一番大きい値が出たincubate 時間 (すなわち,AI生成速度が一番大きいということ)を本実験の条件に決定する.また,検量線の範囲に入った希釈濃度も本実験の条件にする.
注)結果の値は,もともとサンプル中に含まれる,AI量を引くことで求められる.(incubate 0min.の値を引く.)単位はng AI/ ml plasma or mg protein of tissue/ hr
Radioimmunoassay for AI
Sampleは上記で示したように,全て100ul分を用いる.また,RIAでは,total 1mlのvolumeで抗体反応を行う.AI抗体を用いたRIAの場合を記載する.
そろえるもの(各2連で)
・T(total) RIA buffer 900u 加えたラベルAI量
・CB(Charcoal blank) RIA buffer 900ul Charcoalに結合するラベルAI量
・Z(zero sample) RIA buffer 100ul+抗体solution 800ul 抗体に結合するラベルAI量
・Standard (6つの濃度) standard100ul+抗体solution 800ul 検量線のためのもの
・Sample(測定する対象) sample100ul+抗体solution 800ul
*standardは,既知濃度(41,82,163,325,650,1300pg/100ul )のAIをRIAbufferで希釈したもの
*抗体solution は50ulのAI抗体+750ulのRIA bufferである.
上記のものを実験室でそろえてから,RIにて行う.
↓すべてに125I-AI 100ul(count 10000-120000)を加えて,4℃,8-12hr. (125I-AI;第一化学薬品 NEX-101)
↓T以外にCharcoal 1mlを加えてVortex 抗体に結合しなかったものが吸着
↓4℃,3000rpm,10min.
↓sup回収
↓γ-counterにてcount
E, Radioimmunoassay for human renin
ヒトレニンに対する2種類の抗体でサンドイッチすることで測定できるキットがある.
(レニンIRMA 「第一」;273-000 TFB)
説明書に準ずる.
Pre実験としては検量線にのるsample量を検討する.
