最終更新日 2016.06.11













DAF-16はFoxOサブファミリーに属する線虫 (C. elegans) の転写因子であり、哺乳類のFOXO1やFOXO3のオルソログに相当します。この遺伝子が最初に注目されたのは、線虫を用いた寿命調節遺伝子の発見にさかのぼります。
線虫の長寿遺伝子DAF-16
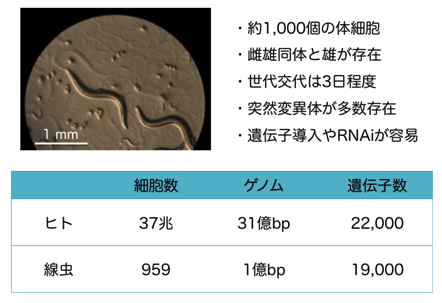
線虫 (C. elegans) は体長1㎜ほどで約1,000個の体細胞からなる最もシンプルな多細胞モデル動物であり、平均寿命が2週間程度と短い上に、遺伝学解析が容易であることから老化研究によく用いられてきました(図)。1993年、Kenyonらによる線虫の突然変異体の解析の結果、daf-2とよばれる遺伝子の機能が低下した変異体は野生型に比べて寿命が3倍近く延長することが明らかになりました。daf-2遺伝子がコードするタンパク質は哺乳類のインスリン/IGF-I受容体と高い相同性をもち、下流のPI3K-Aktシグナル経路も線虫に高く保存されています。さらに重要なことは、daf-2変異体にdaf-16変異体を掛け合わせた二重変異体で、長寿命が完全にキャンセルされてdaf-16変異体と同程度の寿命(野生型よりやや短命)になることです。DAF-16がDAF-2シグナルの下流で負に制御されていることを考えると、daf-2変異体の長寿命は、非リン酸化状態のDAF-16による標的遺伝子の転写活性化に起因すると考えられます。さらに近年、食餌制限や生殖細胞系列の欠損などのdaf-2変異体とは独立した寿命延長経路においても、その長寿命にdaf-16遺伝子が必須であることが報告されていることから、DAF-16/FOXOの活性調節機構の解明は、寿命制御の本質的理解につながるものと考えられます。
我々は哺乳類FOXO1遺伝子の研究で蓄積した知見を、線虫DAF-16の個体機能である寿命制御にフィードバックすることで、寿命・老化メカニズムの解明に挑んでいます。
Tamiya H., Hirota K., Takahashi Y., Daitoku H., Kaneko Y., Sakuta G., Iizuka K., Watanabe S., Ishii N. and Fukamizu A.
Conserved SAMS function in regulating egg-laying in C. elegans
J. Recept. Signal. Transduct. 33, 56-62 (2013)
Takahashi Y., Daitoku H., Hirota K., Tamiya H., Yokoyama A., Kako K., Nagashima Y.,
Nakamura A., Shimada T., Watanabe S., Yamagata K., Yasuda K., Ishii N. and Fukamizu A.
Asymmetric arginine dimethylation determines life span in C. elegans by regulating forkhead transcription factor DAF-16
Cell Metab. 13, 505-516 (2011)
Takahashi Y., Daitoku H., Yokoyama A., Nakayama K., Kim JD. and Fukamizu A.
The C. elegans PRMT-3 possesses a type III protein arginine methyltransferase activity
J. Recept. Signal. Transduct. 31, 168-172 (2011)
哺乳類におけるFOXO1の飢餓応答
グルコース(ブドウ糖)は生体にとって最も利用しやすいエネルギー源であり、全身の細胞は必要なグルコースを血液中から取り込んでいますが、空腹状態が続いて炭水化物の摂取が不足すると、生体は脂肪細胞に貯蔵している脂肪酸を血中に放出して、グルコースに代わるエネルギー源とします。しかし脳や赤血球は脂肪酸を代謝できないため、エネルギー源を血中からのグルコース供給に頼らざるを得ません。したがって血中グルコース濃度(血糖値)は常に基底レベルを維持する必要がありますが、その要求に応えているのが肝臓による血中へのグルコースの供給です。肝臓は空腹時(低血糖時)のグルコース供給に備え、食後の高血糖時に分泌されるインスリンに応答して血中グルコースからグリコーゲン(グルコースの重合体)を合成し、一時的に貯蔵します。そしていざ空腹状態が長く続き肝臓のグリコーゲンが枯渇すると、生体は血糖値を維持するため、肝臓において、乳酸、アミノ酸、グリセロールなどからグルコースを生成し、これを血中に供給する独自の代謝機構(糖新生)を発動させます。FOXO1は糖新生の律速酵素であるG6PaseやPEPCKの発現を誘導することで、空腹時における血糖値維持に重要な役割を果たしています。またII型糖尿病の発症原因のひとつに糖新生の亢進が関与していると考えられており、FOXO1を介した糖新生の制御メカニズムの研究が、糖尿病の発症メカニズムの解明へとつながることが期待されます。
Sakamaki JI, Daitoku H., Kaneko Y., Hagiwara A., Ueno K. and Fukamizu A.
GSK3β regulates gluconeogenic gene expression through HNF4α and FOXO1
J. Recept. Signal. Transduct. 32, 96-101 (2012)
Ito Y., Daitoku H. and Fukamizu A.
Foxo1 increases pro-inflammatory gene expression by inducing C/EBP beta in TNF-alpha-treated adipocytes
Biochem. Biophys. Res. Commun. 378, 290-295 (2008)
Aoyama H., Daitoku H. and Fukamizu A.
Nutrient control of phosphorylation and translocation of Foxo1 in C57BL/6 and db/db mice
Int. J. Mol. Med. 18, 433-439 (2006)
Yamagata K., Daitoku H., Shimamoto Y., Matsuzaki H., Hirota K., Ishida J. and Fukamizu A.
Bile acids regulate gluconeogenic gene expression via small heterodimer partner-mediated repression of hepatocyte nuclear factor 4 and Foxo1
J. Biol. Chem. 279, 23158-23165 (2004)
Hirota K., Daitoku H., Matsuzaki H., Araya N., Yamagata K., Asada S., Sugaya T. and Fukamizu A.
Hepatocyte nuclear factor-4 is a novel downstream target of insulin via FKHR as a signal-regulated transcriptional inhibitor
J. Biol. Chem. 278, 13056-13060 (2003)
Daitoku H., Yamagata K., Matsuzaki H., Hatta M. and Fukamizu, A.
Regulation of PGC-1 promoter activity by protein kinase B and forkhead transcription factor FKHR
Diabetes 52, 642-649 (2003)
4−2. DAF-16/FOXO1の標的遺伝子と個体機能
Last updated on 160611 by H.D.
3.
4.
5.
1.
2.