最終更新日 2013.07.05













3−1. レニン・アンジオテンシン系の血圧恒常性
Last updated on 130705 by K.S., Y.K. and Taro
レニン・アンジオテンシン系(Renin-Angiotensin System:RA系)は、生体の血圧調節、および、電解質バランスの維持に重要な酵素-ホルモン系です。RA系の唯一の基質であるアンジオテンシノーゲンは主に肝臓で産生され、血中へと分泌されます。主に腎臓で産生される酵素レニンは、このアンジオテンシノーゲンを切断し、アンジオテンシンI(AI)が生成され、AIはさらにアンジオテンシン変換酵素(ACE)により、アンジオテンシンII(AII)へと変換されます。AIIは、RA系の最終生理活性ペプチドであり、特異的受容体(AT1)を介して血管収縮や、腎臓における水・電解質の再吸収を促進するなど、血圧を上昇の方向へと導いています。私たちは、マウス個体にて遺伝的にRA系を活性化、または、欠損させることにより、RA系の血圧制御における意義を解明してきました。
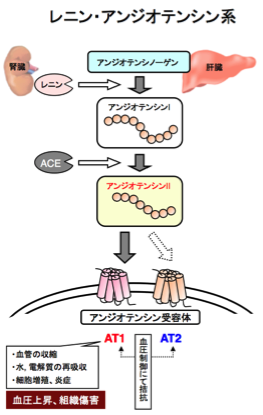
1)血圧制御におけるRA系の重要性(ノックアウトマウスによる検証)
RA系の唯一の基質であるアンジオテンシノーゲン、RA系の律速酵素であるレニン、また、アンジオテンシンIIの血圧上昇作用を担うAT1a受容体について、それぞれの遺伝子ノックアウトマウスを作製しました。これらマウスは、著しい低血圧を示したことから、RA系は、個体内において他の系では代償することが出来ない、正常血圧の維持に必須な血圧制御系であることが証明されました。また、それぞれのマウスにて、腎臓の形成異常や水腎症が観察され、腎臓の形成や機能維持にもRA系は極めて重要であることが明らかとなりました(J. Biol. Chem. 1994、J. Biol. Chem. 1995、J. Biol. Chem. 2000)。
2)RA系の病態生理学的役割(トランスジェニックマウスを用いた検討)
RA系の消失、もしくは、シグナル抑制にて正常血圧保てないことが判明しましたが、RA系の亢進の影響については不明でした。そこで、ヒト・レニン遺伝子導入マウスと、ヒト・アンジオテンシノーゲン遺伝子導入マウスを作製し、それらの交配により、ヒトの両遺伝子をもつ子マウスを作製しました。この、ヒト・アンジオテンシノーゲンとヒト・レニンの両遺伝子を同一個体にて併せ持つ子マウスでは、ヒトのRA系が再構築され、過剰なAIIが産生、そして、慢性的な高血圧を呈しました(つくば高血圧マウス)。このことは、RA系の亢進は高血圧の原因となることを示しています(J. Biol. Chem. 1993)。
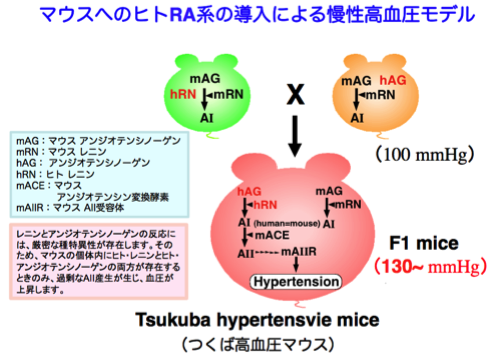
つくば高血圧マウスでは、過剰なアンジオテンシン産生によって、著しい高血圧に加えて、心肥大や臓器障害を含む様々な高血圧病態が観察されることが判明しています(J. Biol. Chem. 1993、Lab. Invest. 1997、Lab. Invest. 1998)。現在、RA系の機能亢進と疾患との関連研究に関しては、次項で述べる妊娠時疾患との関わりに関して研究を進めています。
[references]
1. Fukamizu, A., Sugimura, K., Takimoto, E., Sugiyama, F., Seo, MS., Takahashi, S., Hatae, T., Kajiwara, N., Yagami, K., and Murakami, K.
Chimeric renin-angiotensin system demonstrates sustained increase in blood pressure of transgenic mice carrying both human renin and human angiotensinogen genes.
J. Biol. Chem. 268, 11617-11621 (1993)
2. Tanimoto, K., Sugiyama, F., Goto, Y., Ishida, J., Takimoto, E., Yagami, K., Fukamizu, A., and Murakami, K.
Angiotensinogen-deficient mice with hypotension
J. Biol. Chem. 269, 31334-31337 (1994)
3. Sugaya, T., Nishimatsu, S., Tanimoto, K., Takimoto, E., Yamagishi, T., Imamura, K., Goto, S., Imaizumi, K., Hisada, Y., Otsuka, A., Uchida, H., Sugiura, M., Fukuta, K., Fukamizu, A., and Murakami, K.
Angiotensin II type 1a receptor-deficient mice with hypotension and hyperreninemia
J. Biol. Chem. 270, 18719-18722 (1995)
4. Sugiyama, F., Haraoka, S., Watanabe, T., Shiota, N., Taniguchi, K., Ueno, Y., Tanimoto, K.., Murakami, K., Fukamizu, A., and Yagami, K.
Acceleration of atherosclerotic lesions in transgenic mice with hypertension by the activated renin-angiotensin system
Lab. Invest. 76, 835-842 (1997)
5. Nishijo, N., Sugiyama, F., Kimoto, K., Taniguchi, K., Murakami, K., Suzuki, S., Fukamizu, A., and Yagami, K.
Salt-sensitive aortic aneurysm and rupture in hypertensive transgenic mice that overproduce angiotensin II
Lab. Invest. 78, 1059-1066 (1998)
6. Ishida, J., Sugiyama, F., Tanimoto, K., Taniguchi, K., Syouji, M., Takimoto, E., Horiguchi, H., Murakami, K., Yagami, K., Fukamizu, A.
Rescue of Angiotensinogen-Knockout Mice
Biochem. Biophys. Res. Commun. 252, 610-616 (1998)
7. Kakinuma, Y., Hama, H., Sugiyama, F., Yagami, K., Goto, K., Murakami, K., and Fukamizu, A.
Impaired blood-brain barrier function in angiotensinogen-deficient mice
Nature Med. 4, 1078-1080 (1998)
8. Taniguchi, K., Sugiyama, F., Kakinuma, Y., Uehara, S., Nishijho, N., Tanimoto, K., Murakami, K., Fukamizu, A., and Yagami, K.
Pathologic characterization of hypotensive C57BL/6J-agt: angiotensinogen-deficient C57BL/6J mice
Int. J. Mol. Med. 1, 583-587 (1998)
9. Yanai, K., Saito, T., Kakinuma, Y., Kon, Y., Hirota, K., Taniguchi-Yanai, K.,
Nishijo,N.,Shigematsu, Y., Horiguchi, H., Kasuya, Y., Sugiyama, F., Yagami, K., Murakami, K.,and Fukamizu, A.
Renin-dependent Cardiovascular Functions and Renin-independent Blood Brain Barrier Functions Revealed by Renin-deficient Mice
J. Biol. Chem. 275, 5-8 (2000)
3.
4.
5.
1.
2.